药物警戒���:药物全生命周期的风险监管制度(下)
钟月萍 黄晓琳 王向雨 陈奕搏
阿仑单抗是一款已获批上市用于治疗成人复发缓解型多发性硬化的单克隆抗体。2020年2月12日���,英国药品和健康产品管理局(MHRA)发布警示信息���,基于一项关于阿仑单抗治疗多发性硬化的获益和风险(包括致命的不良反应)评估结果���,应限制阿仑单抗的适应症���,增加新的禁忌症���,加强监测(如密切监测患者在输液前���、中���、后阶段的反应等)以及更新风险管理计划(如在开阿仑单抗处方前���,向患者提供指南及警示卡���,并与患者讨论治疗的风险)。 阿仑单抗可能引发的心肌梗死���、肺泡出血和动脉夹层等不良反应仅可在上市后监测中观察到。上市后的药物警戒工作可以发现临床试验阶段难以发现���、预测的其他不良反应���,以持续不断地更新药物的风险信息���,便于指导持有人���、医疗机构���、医务人员���、患者等通过更合理有效的方式控制药物的风险。 本文将以问答形式���,针对药品上市后的药物警戒义务的热点问题进行简要解答。
一���、药品上市后的药物警戒义务主要包括哪些内容?
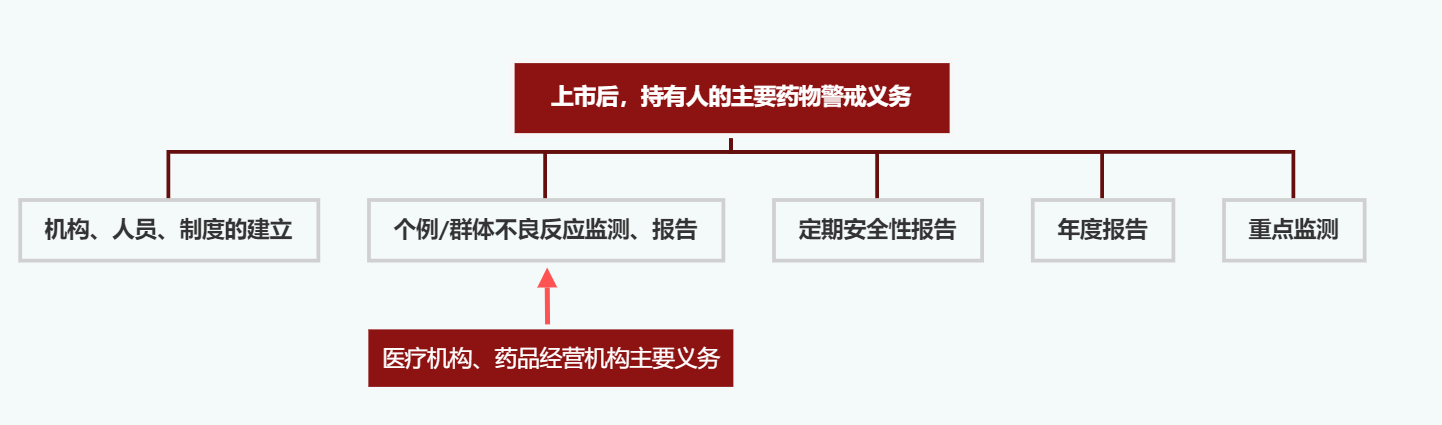
关于相关主体药物警戒义务的规定可见于《药品管理法》(2019年)���、《关于药品上市许可持有人直接报告不良反应事宜的公告》(2018年第66号)���、《药品不良反应报告和监测管理办法》(2011年���,“原管理办法”)���、《关于发布个例药品不良反应收集和报告指导原则的通告》(2018年)等规定���,以及2020年2月国家药监局综合司发布的《药品上市许可持有人检查要点》(“检查要点”)(征求意见稿)中。根据上述规定���,持有人是药品安全责任的主体。药品上市后���,上市许可持有人应当建立不良反应监测体系(机构���、人员���、制度)���、监测���、收集和报告个例/群体不良反应���、提交年度报告���、提交定期安全性更新报告���、实行重点监测。其他主体的药物警戒义务(包括医疗机构���、药品经营机构)则主要体现在对发现的个例/群体不良反应的报告方面。
二���、从事不良反应监测的人员应当具备什么资质?
药品不良反应监测体系要求持有人设立专门机构���、配备专职人员���、指定药品不良反应监测负责人���,并建立完善���、健全的药品不良反应信息的收集���、报告和处置等管理制度。
其中���,根据国家药品监督管理局官网公布的《<关于药品上市许可持有人直接报告不良反应事宜的公告>政策解读》���,药品不良反应监测负责人是持有人指定的直接主管药品不良反应监测工作���,且具有一定领导职务的人员。该人员应当具备多年从事药品不良反应监测工作经验���,熟悉相关法律法规及政策���,能够负责药品不良反应监测体系的建立���、运行和维护���,确保监测工作持续合规。专职人员应当具有医学���、药学���、流行病学或者统计学等相关专业知识���,具备科学分析评价不良反应报告和识别评估药品风险的能力。如持有人委托其他公司或者机构开展药品不良反应监测工作���,持有人还应当配备专职人员做好对受托方的监督和管理等工作。
三���、持有人如何收集个例药品不良反应?
《个例药品不良反应收集和报告指导原则》(2018年第131号)中就持有人(包括持有药品批准文号的药品生产企业)个例不良反应的监测���、收集义务进行了详细的规定���,其中包括���,持有人应建立面向医生���、药师���、患者等的有效信息途径���,主动收集临床使用���、临床研究���、市场项目���、学术文献以及持有人相关网站或论坛涉及的不良反应信息。 此外���,131号文还进一步地规定了持有人通过上述途径收集不良反应信息的具体要求���,如持有人应定期向医务人员收集不良反应信息���、持有人进行学术文献检索的最低频率要求���、持有人应确保其于药品说明书���、标签���、持有人门户网站公布的联系电话畅通���,工作时间应有人接听���,非工作时间应设置语音留言;电话号码如有变更���,应及时在说明书���、标签以及门户网站上更新等。
四���、何为持有人药品不良反应报告的范围和时限?
持有人���、药品经营机构���、医疗机构应当及时报告获知的所有不良反应。 其中持有人针对不同类型不良反应的报告范围及时限如下���:
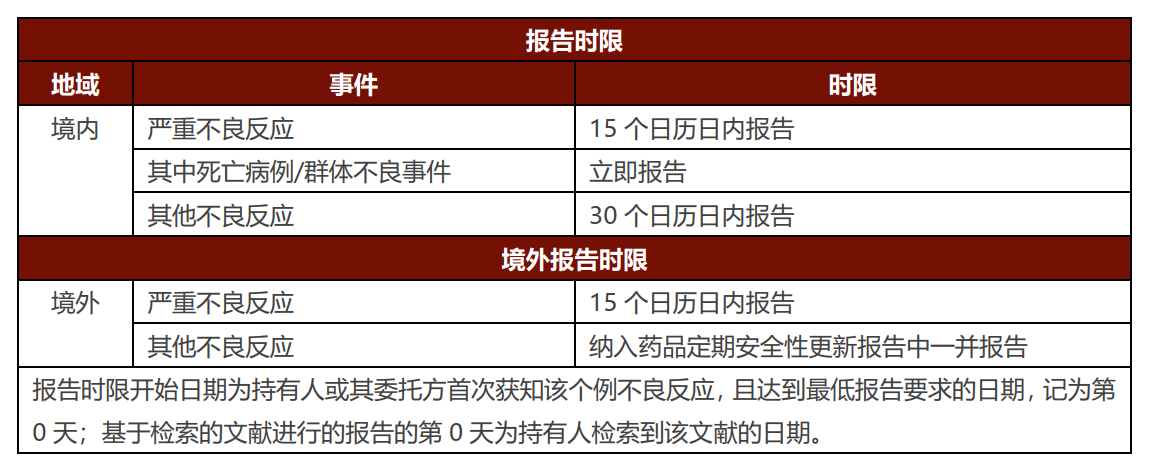
持有人报告范围���:不良反应事件的报告原则为“可疑即报”���,直接通过国家药品不良反应监测系统报告发现或获知的药品不良反应。报告范围包括患者使用药品出现的与用药目的无关且无法排除与药品存在相关性的所有有害反应���,即���,既包括药品在正常用法用量下出现的不良反应���,也包括在超说明书(如超适应症用药���、超剂量用药���、禁忌症用药)用药情况下发生的有害反应。
五���、何为药品经营企业���、医疗机构的报告时限及范围?
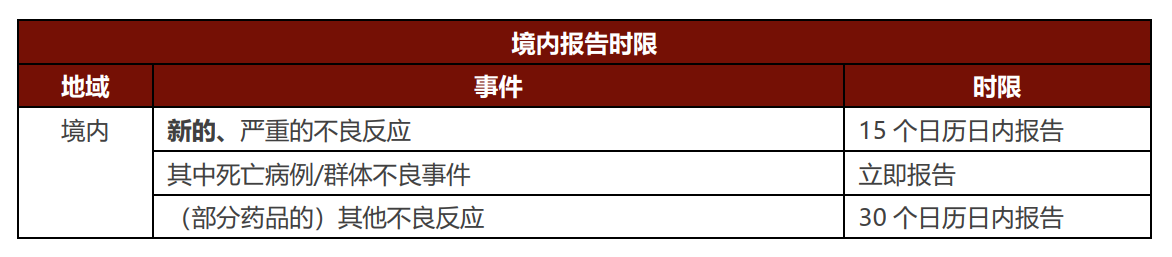
药品经营企业���、医疗机构报告范围���:医疗机构保持原途径(即国家药品不良反应监测系统)报告不良反应���,也可向持有人直接报告。药品经营企业应直接向持有人报告。 按照原管理办法的规定���,药品经营企业���、医疗机构的报告范围为新药监测期内的国产药品应当报告该药品的所有不良反应;其他国产药品���,仅报告新的和严重的不良反应;进口药品自首次获准进口之日起5年内���,报告该进口药品的所有不良反应;满5年的���,仅报告新的和严重的不良反应���,较持有人的报告范围有所缩小。但鉴于自2020年起开始施行的新《药品注册管理办法》中删除了关于“监测期”的相关概念���,且原管理办法尚未进行更新���,故建议药品经营企业���、医疗机构持续关注后续法律对新药监测期的规定���,以确定其不良反应的报告义务。
六���、如何撰写年度报告?
持有人应当汇总年度情况���,包括企业年度药品不良反应监测体系运行情况���、不良反应报告情况���、风险识别与控制情况���、上市后研究情况等信息���,并于每年3月31日前向省级药品不良反应监测机构提交上一年度总结报告。 为指导持有人年度报告的撰写���,国家药品不良反应监测中心组织制定并于2019年11月发布了《药品上市许可持有人药物警戒年度报告撰写指南(试行)》。
七���、药物警戒义务能否委托第三方?
持有人可以委托第三方机构开展药物警戒工作���,委托事项包括但不限于以下技术工作内容���:个例药品不良反应和境外发生的严重药品不良反应收集���、报告���、评价���,聚集性信号发现及处置���,药品群体不良事件报告及处置���,文献检索���、评价���,药品风险信号监测���、识别���、评估和控制���,药品重点监测���,药品上市后安全性研究���,定期安全性更新报告���,持有人药品上市后不良反应监测年度报告等。 为了进一步规范和指导持有人与受托人就药物警戒委托的关系���,国家药品不良反应监测中心于2020年6月组织制定了《药物警戒委托协议撰写指导原则(试行)》���,供持有人参考。
八���、违反药物警戒义务的后果
持有人未按照规定开展药品不良反应监测或者报告疑似药品不良反应的���,存在被责令限期改正���、给予警告���、责令停产停业整顿并处以最高可达100万元罚款的风险。 药品经营企业���、医疗机构未按照规定报告疑似药品不良反应的���,存在被责令限期改正���、给予警告���、责令停产停业整顿并处以最高可达50万元罚款的风险。




